パーキンソン病治療の新しい展開
沖縄県立南部医療センター・こども医療センター神経内科
神里 尚美
【要 旨】
パーキンソン病(Parkinson’s disease: PD)は黒質緻密部のドパミン系細胞の脱落 により線条体ドパミンが枯渇し、運動障害を生じる疾患である。運動障害を発症す る数年前から発症早期に急激に細胞脱落を生じるので、この時期の細胞保護薬や抗 PD 薬による治療が重要である。
PD 安定期を経て数年後より運動合併症を生じるようになり、脳深部刺激法 (DBS)が選択される場合がある。手術のリスクとベネフィットを考慮して手術適 応を決定する。術後の刺激条件の管理により、術後長期に及ぶ有効性を得ることが 可能である。
1)はじめに
パーキンソン病(Parkinson’s disease: PD) は潰瘍性大腸炎と共に、特定疾患受給者が経年 的に増え続けている疾患である(図1)。沖縄県 では約900 人の患者が受給を受けている1)。
加齢と共に有病率の増加する疾患であるが、 若年発症のため就労しながら治療を継続してい る症例も多い。
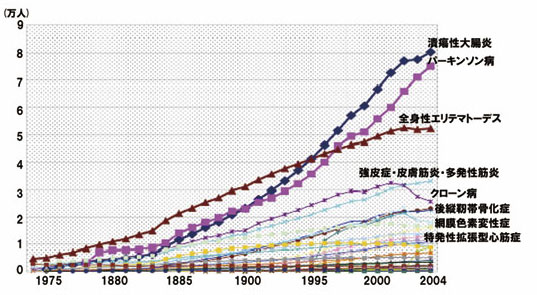
図1.日本のパーキンソン病(PD)患者数の推移1)。PD 受給者数は、約8 倍に増加している。
沖縄県のPD 受給者は909 人(2008 年3 月時点)。
パーキンソン症候を中核症状とする神経変性 疾患には、PD 以外にもレビー小体型認知症 (dementia with Lewy bodies : DLB)、多系 統萎縮症(Multiple system atrophy: MSA)、 進行性核上性麻痺(progressive supranuclear palsy: PSP)、大脳皮質基底核変性症(corticobasal degeneration: CBD)などがある。こ れらを異常蛋白の蓄積により分類すると、αシ ヌクレインが神経細胞内に蓄積しレビー小体を 形成するPD とDLB、αシヌクレインがグリア 細胞内に蓄積するMSA、タウ蛋白が神経細胞 内に蓄積し神経原線維変化を形成するPSP と CBD に大別される。
PD では、黒質緻密部(SNc)の細胞が著明 に脱落し残存神経細胞内にレビー小体が出現す る。変性の局在性がPD の神経病理の特徴で、 線条体・淡蒼球・視床・視床下核に細胞脱落は みられない。PD の運動障害は主としてドパミ ン系の細胞脱落に起因する。
PD では、青斑核や迷走神経背側核、交感神 経節、背側縫線核などにも神経細胞脱落を生 じ、自律神経症状や精神症状など、ノルアドレ ナリン系、交感・副交感神経系、セロトニン系 の細胞脱落に起因する症状を呈する2)。
2)大脳皮質基底核回路による運動調節、及び 脳機能手術の治療メカニズム
随意運動開始の指令が前頭葉から発せられる と、ハイパー直接路と呼ばれる大脳皮質から視 床下核(STN)への促通性投射路が活性化す る。その結果、淡蒼球内節(GPi)・黒質網様 部(SNr)を経て視床や大脳皮質が広範に抑制 され運動開始の準備が整う。続いて大脳皮質か らの刺激により線条体からGPi/ SNr へ投射す る直接路が活性化し、直接路は視床の特定の領 域のみ脱抑制し、選択された運動プログラムの みが抑制から解除される。さらに線条体から淡 蒼球外節(GPe)やSTN を経由する間接路に よりGPi/ SNr に抑制がかかり、拮抗する運動 が抑制される。これらの一連の情報伝達により 目的とする運動が適切に開始され円滑に遂行さ れる(図2)3)。
PD では黒質の変性により線条体ドパミンが 枯渇し直接路への促通が低下し、間接路でも線 条体から淡蒼球内節(GPe)への抑制性線維の 抑制が不十分となり、結果GPi/ SNr から視床 への抑制が必要以上に増強する。PD では随意 運動の指令が発せられても、直接路・間接路を 介して視床が不適切に抑制され大脳皮質の活動が適切に行われず、運動開始の遅れや運動量の 減少を生じる。
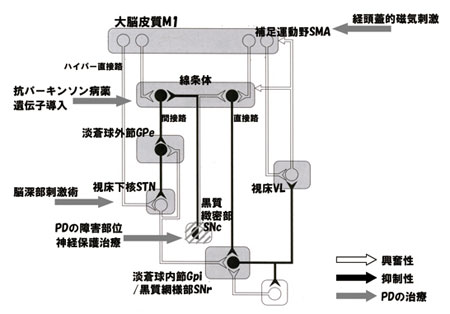
図2.大脳皮質基底核路による運動調節3)。ドパミンは直接路優位に、アセチルコリン間接路優位にバランスを傾ける。
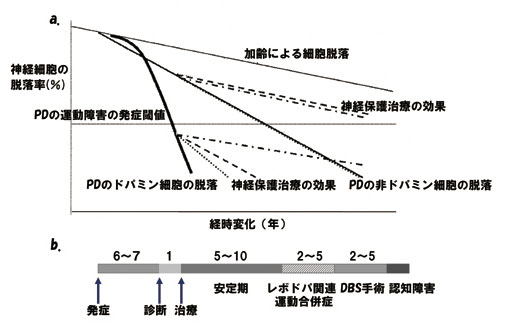
図3.パーキンソン病の発症と進行3)。ドパミン作動性神経は運動症状発現の数年前より急激に脱落する。
PD では黒質ドパミン細胞の約50 %、または 線条体ドパミン終末の約70 %が脱落して初め て症状が発現する(図3a)4)。発症前の線条体 のドパミン濃度を保つための代償機構として、 STN やGPi の発火が上昇し、黒質緻密部ドパ ミン細胞への興奮性入力となっている可能性が PD モデル動物で示唆された5)。
大脳基底核内のニューロンは正常ではランダ ムに発火しているが、PD では病的な同期発火 を起こしており、レボドパの内服や脳深部刺激 術(deep brain stimulation : DBS)により 回路全体の同期放電を脱同期させて、機能回復 を得るとされる。
3)脳深部刺激法(DBS)の県内の治療状況
DBS は2000 年にPD で保険適応が認可さ れた。
脳深部の刺激電極と、胸部皮下に埋め込んだ 刺激発生装置(implantable pulse generator : IPG)を連結し慢性刺激を行う。専用プ ログラマーにより刺激活性点や刺激条件を調節 することにより、PD の運動障害の変化に対応 する。
米国神経学会治療ガイドライン作成小委員会 による報告では、PD の運動機能の日内変動や ジスキネジア、抗PD 薬の服薬量の減少につい てSTN-DBS は有効(Level C)とされ、有 害事象についての危険性と有効性を判断のうえ に行うとされる6)。
本邦では約3,000 人の患者がDBS 手術を受 けており、沖縄県では14 症例がDBS 手術を受 けている(図4)。14 症例の平均年齢は49 歳 (34 〜 72 歳)、平均罹病期間は12 ± 5 年(7 〜 23 年)、平均レボドパ投与量は770 ± 590mg/ 日(250 〜 2,000mg)であった。
手術は東京や福岡のDBS センターに依頼し、 手術後のIPG 管理を当科で行っている。
手術前の運動スコア(unified Parkinson’s disease rating scale、UPDRS)は30 点以上 と重度で日常生活動作(activity of daily living, ADL)自立度も低いが、術後1 年で個人 差はあるが改善している(図5 a,b)。
手術の適応は、60 歳以前にPD を発症し治 療5 〜 10 年でレボドパ反応性の運動合併症を 生じた場合である(図3b)。パーキンソン症候 群を除外、認知症は絶対禁忌、脳画像で萎縮性 変化や動脈硬化のある症例は手術のリスク/ベ ネフィット比は良好でない。70 歳以上の症例 や、治療コントロールされた精神症状を伴う症 例については、個人毎に決定している7)。
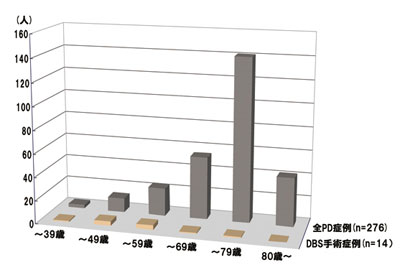
図4.当科のパーキンソン病患者の年齢分布。 DBS手術を受けた14例の平均年齢は49歳(34〜72歳)。
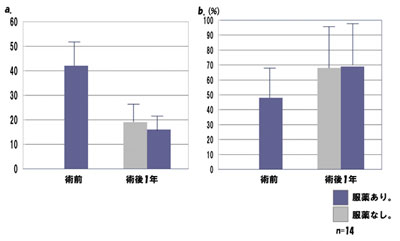
図5.DBS 手術後の治療効果。
a.運動スコア(UPDRS # part 3)。
b.ADL 自立度(Schwab and England Scale of ADL score)。
DBS 手術前の服薬ありの運動スコアは30 点以上で重度であった。
DBS 手術後にADL 自立度は改善しているが、個人差がある。
# UPDRS, Unified Parkinson’s disease rating scale
STN-DBS の長期予後については、術後5 年 後も運動機能が術前に比較して有意に維持され ており、前頭葉機能の若干の低下はPD の疾病 自体の進行によるものが大きいと報告される8)。
STN-DBS の神経保護の可能性については、 PD モデル動物においてSTN-DBS を施行し、 黒質ドパミン含有細胞が保たれていたと報告さ れた。現在、早期PD 例におけるSTN-DBS の神経保護効果について臨床試験が開始されて いる9)。
4)抗パーキンソン病薬による神経保護、PD 治療の今後の展開
ドパミン作動性神経は、運動障害の発現する 数年前から発症早期に急激に低下する(図3a)。 早期PD 症例でレボドパを投与した群は、12 カ 月後にレボドパを休薬した後も、無治療のプラ セボ群に比較し有意に運動機能が保たれていた (ELLDOPA study、Level A)。
一方、ドパミン作動薬は早期PD 症例におい てジスキネジアの発現を有意に抑えたが (Level A)、数年で約半数が脱落しレボドパ併 用になっている。
黒質の細胞死抑制、または神経幹細胞の新生 を促進する神経保護治療の開発や臨床研究が進 められる中で、ドパミン作動薬の神経保護作用 がin vivo で示され、将来的な展開が待たれて いる10)。
当科管理のPD 276 例の運動機能予後を Kaplan-Meier 分析を行ったところ、発症より 約15 年でHoehn & Yahr stage 4 に至り、 ADL 自立度を失っていた。抗PD 薬や神経保 護薬によりPD 安定期を維持する医療者の努力 と、患者の疾病との共生、希望や意欲の維持に より、良好な疾病コントロールを目差したい。
DBS 治療などの機能外科治療や遺伝子導入な どの再生医療の進展を目前にしながら、我々は 日々の患者管理を地道に行っていく必要がある。
文献
1)神里尚美. 沖縄県の神経難病治療と支援ネットワーク
の歩み.
全国難病センター研究会第11 回研究大会報告集.厚生
労働科学研究費補助金難治性疾患克服研究事業「重
症難病患者の地域支援体制の構築に関する研究班」
2009 年度.
2)伊藤秀文. パーキンソニズムに対する脳機能手術の神
経病理.
薬物治療と機能外科の融合PD シンポジウム.2008、
26: 6-15.
3)Bear M.F., et al. Brain control of movement.
In: Neurosience, Philadelphia, PA: Lippincott Williams
& Wilkins, 2007, 452-478.
4)Lang, AE. The progression of Parkinson disease.
Neurology 2007, 68: 948-952.
5)下泰司. パーキンソン病における視床下核の役割と薬
物療法.
薬物治療と機能外科の融合PD シンポジウム.2008、26: 46-51.
6)Pahwa R., et al. Practice parameter: treatment of
Parkinson disease with motor fluctuations and
dyskinesia(an evidence-based review).
Neurology 2006, 66: 983-995.
7)Lang AE., et al. Deep brain stimulation: preoperative
issues.
Movement Disorder 2006, 21(Suppl 14): S171-237.
8)鈴木裕. パーキンソン病に対する視床下核刺激療法の
長期効果.
薬物治療と機能外科の融合PD シンポジウム.2008、26: 41-45.
9)Charles PD., et al. Is deep brain stimulation
neuroprotective if applied early in the course of PD ?
Nature clinical practice Neurology 09/17/2008
10)H glinger GU., et al. Dopamine depletion impairs
precursor cell proliferation in Parkinson disease.
Nat Neurosci. 2004, 7: 726-735.
著 者 紹 介

沖縄県立南部医療センター・こども医療センター
神経内科副部長 琉球大学医学部非常勤講師
神里 尚美出身大学:
琉球大学医学部医学科 1990年 卒業専攻・診療領域
神経難病・ボツリヌス治療・免疫性神経疾患・頭痛の専門外来。
琉球大学医学部・沖縄県看護協会・県立消防学校・リハビリテーション関連の非常勤講師。
沖縄県の難病訪問診療事業を2000年度から担当。学会・資格
日本神経学会認定専門医・指導医。
日本頭痛学会専門医。
日本神経生理学会認定脳波・筋電図専門医。
日本内科学会認定医・指導医。
厚生労働科学研究事業神経難病相談支援ドクター。
医学博士
Q U E S T I O N !
問題:パーキンソン病で黒質緻密部のドパミン 細胞内に蓄積するレビー小体を構成する タンパク質を以下より選択してください。
- 1)タウ蛋白
- 2)パーキン蛋白
- 3)αシヌクレイン
- 4)アミロイドβ蛋白
CORRECT ANSWER! 5月号(vol.45)の正解
感染性胸部大動脈瘤の外科治療
―人工血管の大網被覆による人工血管感染予防効果―
問題:感染性胸部大動脈瘤について正しいのは どれか。
- a.細菌性心内膜炎を伴っており、弁膜症を合 併する。
- b.臨床的に慢性に経過するため感染を制御し てから、当該専門へ紹介する。
- c.ステントグラフトによる治療を行ってはな らない。
- d.感染瘤であるため、瘤切除し非解剖学的再 建を行う。
- e.Mycotic aneurysm は感染性大動脈瘤の意 味である
正解 なし
解説:いずれも×である。感染性大動脈瘤の なかで、細菌性心内膜炎が初発でその後細 菌性塞栓子により動脈瘤が発症するもの を、Mycotic aneurysm と称している。そ の臨床経過は急激であり、破裂の危険性を 常にはらんでいるため診断が確定した時点 で、心臓血管外科へ転科すべきである。腎 動脈以下腹部大動脈の感染瘤であれば、瘤 切除非解剖学的再建が可能であるが、胸部 大動脈では通常行われていない。In situ の再建を余儀なくされる。最近はステント グラフトによる治療も試みされている。こ れも、感染性胸部大動脈瘤に対する外科治 療成績がまだ不良なためである。ステント グラフトは、その低侵襲性は魅力であり、 一時的に使用して循環動態を改善した後に 手術による人工血管置換術をおこなったと の報告も認める。