グリオーマ治療の問題点
琉球大学医学部脳神経外科
教授 吉井 與志彦
【要 旨】
グリオーマ診療に関して、私達のこれまでの研究成果、及び最近の文献的知見も 加えて、グリオーマの生物学的性質を、colonal/genetic heterogeneity, proliferative potential/tumor cord, therapy related factor, therapy strategy based on glioma biology からグリオーマの持っている治療に対する生物的したたかさを解説 し、次にその状況の中で、臨床的な診断、手術、術後補助療法について現状の治療 法を紹介した。さらに、治療に伴う深刻な認知機能を含めた副作用に言及し、今後 の治療展望についても私見を述べ、グリオーマ治療が抱えている多くの問題点を概 説した。
1.グリオーマの生物学的性質
(1)clonal/genetic heterogeneity
グリオーマの生物学的性質に腫瘍細胞の不均 一性がある。初発時は良性であったグリオーマ が再発時には悪性化した場合、D N A の Diploidy がAneuploidy となり、p53 mutation が出現してくる(subclonal expansion)ため と説明されたり(図1)、一方では、初発時良 性と診断されても詳細に検討すると、p53の mutation をもった悪性組織がわずかに存在し、 再発時にそれが主体となり(図2)、結局は腫 瘍のclonal/genetic heterogeneity の存在が示 唆されている。治療の側からは、グリオーマの 腫瘍組織から、cell line 化したsubclonal cell の中には、radiation やchemotherapy に、sensitive なclone もあれば、resistant なclone も あるという、therapeutic heterogeneity の性 質もあることがわかっている。
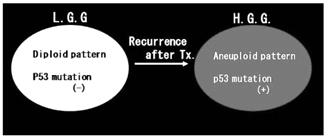
図1
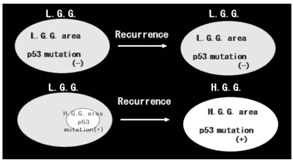
図2
(2)proliferative potential/tumor cord
悪性腫瘍は高い増殖能をもつことがその本質 であるが、腫瘍増殖能の測定は、腫瘍細胞が G1-M 期の細胞周期に入っている細胞が染色さ れるKi-67(MIB-1)抗体での陽性細胞率算出 によって評価ができるようになり、悪性度の指 標となる。我々は、この陽性率が10 %を越え た場合は要注意としている。しかし抗癌剤や放 射線治療の投与・照射のタイミングはこの情報からは得られない。実験的なデータやこれまで の臨床例から推測される値は、悪性グリオーマ では、増殖率は30 〜 40 %であり、腫瘍倍加時 間は、約3 〜 9 ケ月である。
また1 本の血管がどのくらいの半径で、どの くらいの数の腫瘍細胞を養うか分かれば、薬剤 の投与法や放射線照射法を効率的に行える利点 がある。増殖の活発な部位での、我々の試算で は約40μm の半径内で、約16 ケの細胞、しか も細胞周期の細胞はその約30 %であるので、 それらに殺細胞効果の維持出来る薬剤であれ ば、腫瘍はコントロールされると推測された13)
(3)therapy related factor
治療感受性に関係するgenetic factor の報告 例をまとめると、p53 変異やBax 発現の上昇や FGGR-2(Bek)の上昇は治療感受性を高める という報告、Oligodendroglioma に関しては 1p/19q LOH がPCV 治療の感受性を高める という報告、一方Detoxifying enzyme (SOD、 GST-pi、methallotionein 等)の発現やbcl-2 oncogene の発現と治療抵抗性を報告している 例もある。
一方clonality の面からも同様に、1 つの治 療感受性(抵抗性)株から成っているグリオー マもあれば、治療感受性(抵抗性)株が2 つか ら成っている場合もあり、3 つ以上の株から成 っているグリオーマ等、色々ある(図3)。
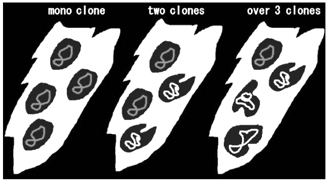
図3
また治療抵抗性という点で、初発、再発時に 同じmonoclonality であった、同じ患者のグリ オーマのラジカルスカベンジャーの発現が、再 発時には高い症例もあり(図4)、治療抵抗能力を獲得する事実があるように考えられる14)。
さらに臨床例の蓄積から、グリオーマの生命 予後因子として年齢、組織型、残存腫瘍容積、 Karnofsky performance sacale が報告され、 治療適応の参考にすべき要素もコンセンサスと して一般化している。
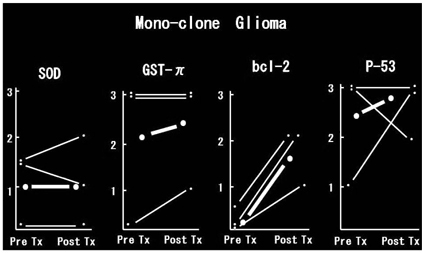
図4 治療抵抗性因子であるラジカルスカベンジャー SOD,bcl-2,GSTpi を見ると治療後再発した症例には、 クローンが単一のままであるにも拘わらず、再発時にそ れら因子の高発現を見る場合がある。
(4)therapy strategy based on glioma biology
結局グリオーマの治療は、前述のような生物 学的特性を考慮して治療計画を組むべきで、治 療者は積極的・重点的な治療計画たてる事が必 要である(図5)
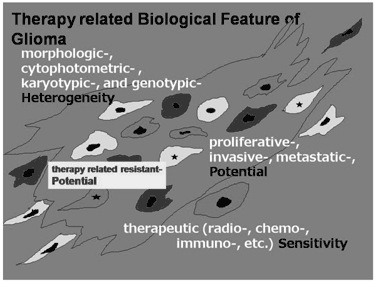
図5
我々の施設でも、腫瘍を手術によって肉眼的 全摘し、術後高気圧・放射線治療、化学療法に より初期寛解導入し、その後画像の定期的チェ ックや化学療法をしつこくやっている(図6)

図6
2.グリオーマ診断
グリオーマの診断に、Gd-MRI は一般的であ り、画像的な特徴も確立されている。しかし grading の鑑別診断には、他の補助検査も必要 である。一般的には、核医学検査の201T l - SPECT 検査で、悪性度が高いほど取り込みが 強い(201Tl は細胞膜のNa-K ポンプにおいて K と同じ動態を持つため、代謝の活発な悪性腫 瘍に細胞膜を介してK の代わりに201Tl が取り込 まれるという機序から)。Magnetic resonance spectroscopy(MRS)も有効で、悪性度が高 いほどcholine 値が高いことで診断できるが、 補助療法後に再発組織と壊死所見が混在してい る場合は、鑑別診断が困難な時がある。また positron emission tomography(PET)では、 ブドウ糖代謝を標的にした画像で診断できる。 viability 診断には、C11-methioninePET がより 精度が高く有効だが、現状では保険診療になっ ていない。MRI によるADC 評価も診断に試み られているがまだ一般的ではない。
グリオーマの初発診断は、通常の診断機器で高 い精度で診断出来るが、放射線・化学療法等の 補助療法後の再発診断は困難なことが多く、 種々の機器による所見を組み合わせて診断すべき であり、ときには腫瘍生検術を行うこともある。
3.グリオーマ手術
グリオーマ手術は、境界鮮明に見えても、浸 潤範囲が正確に診断できない場合が多く、摘出 範囲と神経機能の温存との兼ね合いが常に術者 を悩ませている。解決する方法として、手術の 際に術者に、どの部位の腫瘍を摘出しているの かが示される手術支援装置としてのneuronavigator の使用7)や、手術場にCT,MRI を設置 して、手術中に撮像し、摘出範囲を確認する方 法9)、また言語野などの高次脳機能野付近の腫 瘍を摘出する際に、手術中に脳を刺激して、高 次機能野を確認・温存しながら摘出する覚醒手 術(awake neurosurgery)、5-ALA という特 殊な蛍光剤を手術前に静注し、手術中に赤い蛍 光を発する腫瘍組織を摘出するphotodynamic neuronavigation surgery 等が行われている。 最近は術前にdiffusion MRI によって撮像され たtractgraphy を用いて、重要な神経線維路と 腫瘍の関係を画像化して摘出時に神経線維を損 傷させない工夫もされている1)。
我々のグリオーマ手術には、neuronavigator を使用して、一塊として摘出し、術後は、集学 的治療を行い、数年間は、きめ細かく治療計画 を立て、維持療法を行っている(図6)。このよ うにして広範囲に摘出術を行ったグリオーマ症 例とそうでない症例の生存率では、広範囲摘出 群のほうが生存率は有意に延長しており、摘出 範囲はできる限り大きくするほうが予後がよい といえる15)。
4.グリオーマの術後補助療法
グリオーマが浸潤性の性質を持っているの で、手術だけの根治は、ごく特殊なグリオーマ のみで、多くは術後に補助療法を行う。術後補 助療法として、放射線治療、化学療法、免疫療 法がある。放射線治療は、慣用放射線治療が標 準治療であるが5)、放射線の生物・物理学的長 所からは重粒子放射線治療が有効であるとされ ている。現在千葉県の放射線医学総合研究所の 重粒子医科学センターで臨床試験がなされてい るがまだ治療法が確立されていない。定位放射 線もグリオーマ治療に関しては、適応が限られ ている。我々は、術後は悪性のグリオーマに は、高気圧治療と、慣用放射線・化学療法の3 者併用療法を行っている。
化学療法は、その限界である骨髄抑制と毒性 の問題を解決すべく、腫瘍内のみの濃度を高め る投与法や既存薬剤の新しい組み合わせ方、新 しい薬剤の応用が模索されている。近年標的化 学療法が一般的となりつつあり2,3)、腫瘍血管を 標的としたthalidomide10)、アバスチン肝代謝 を経ない経口薬剤のtemozolomide が臨床応用 されている。現状ではthalidomide はあまり期 待できなかったが、temozolomide が放射線治 療と併用することによって生存期間を有意に延 長しており、本邦でも普及して来ている。
腫瘍の分子生物学的評価と薬剤の抗腫瘍効果 との研究成果から、染色体1p19q 欠乏のoligodendroglioma にはPCV 療法が有効であり、 MGMT(06-methylguanine-DNA methyltransferase の略で、単独で06 部位のアルチル 基を除去し、DNA を正常に復する作用のある 酵素。この活性が高いと抗癌剤への耐性が強く なる)発現のない悪性グリオーマには、ACNU、 temozolomide などが有効であるとされ4,8,9)、ま たEGFR( Epidermal Growth Factor Receptor の略、腫瘍増殖因子の1 つである) の発現によってはその発現を抑える薬剤の使用 が考慮されるようになった。
免疫療法は、現在まで種々試みられてきた が、どれも決定的ではない。近年腫瘍ワクチン 療法も期待される治療法と位置づけられてお り、我々の施設も東京女子医大の共同研究に入 って3 例ほど行ったが、まだ十分な成果は得ら れていない。
5.グリオーマ治療後の認知機能とadverse effect
我々のグリオーマ治療も積極的・集学的にや っているが、得られた長期生存者に、幾つかの 社会的・生活的な問題が出ている事実もある。 琉球大学教育学部臨床神経心理学分野との共同 研究で、腫瘍の存在部位、悪性度、摘出範囲に よる認知機能の評価を検討したが、腫瘍が右脳 (劣位半球)の場合は、良性悪性グリオーマ共 に手術前後の認知機能は正常であった(図7)左脳(優位半球)の場合は、悪性グリオーマ は、どの部にあっても認知機能は手術前から低 下し、手術後も正常化せず(図8)、腫瘍悪性 度や摘出度と認知機能低下は相関なかった。結 論的には「グリオーマに対する摘出術は、認知 機能からは右脳(劣位半球)は積極的に、改善 を目指して行うべきであり、一方左脳(優位半 球)は改善を期待せず、生命予後を考慮した適 応となる」ということであった16)。

図7(タテ軸は3MS 得点、85 点以上は正常)
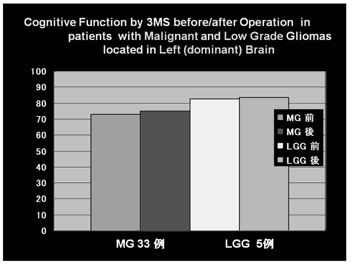
図8(タテ軸は3MS 得点、85 点以上は正常)
認知機能の他に、補助療法後の合併症として、 摘出腔周辺にGd 増強域が出現し、腫瘍再発と鑑別が困難な放射線壊死がある。これによって も認知症を発症することはある。脳放射線壊死 は、一般には、GdMRI では、増強効果を持ち、 201Tl-SPECT で201Tl の取り込みがないことで 腫瘍再発と鑑別される(図9)。しかし最近の研 究では、201Tl の取り込みのみられる例もあり、 また照射野内であれば、部位や時期を変えて何 時でも出現しうる合併症であるといえる(図 10)。この合併症を防ぐために、改良治療法が 考えられているが、まだ解決していない。
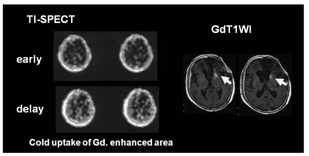
図9
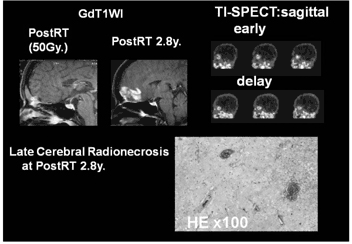
図10
6.グリオーマの今後の治療展望
グリオーマに画期的な治療法がない現状にお いては、これまでの研究成果を基にすると、根 治が期待できしかも手術、放射線、化学療法す べてで副作用が出にくいグリオーマは、劣位半 球にあって、腫瘍は比較的境界鮮明で、発生部 位は前頭葉、側頭葉、後頭葉の非高次機能部で ある。左脳、優位半球の場合は、組織型は良性 グリオーマで、比較的境界鮮明な非高次機能部 にある腫瘍で、このような腫瘍には、全摘術を 行い、放射線・化学・免疫療法を根治的に行う。
根治を期待するが副作用が出る可能性のある グリオーマは、左脳、優位半球にあって、比較 的境界鮮明腫瘍で、前頭葉、側頭葉、後頭葉の 非高次機能部に存在する場合である。
このようにグリオーマ治療は、腫瘍因子、治 療因子、予後因子、副作用因子を考える必要が あり、その4 つの因子がうまくかみ合うグリオ ーマが根治治療の適応になると考えられ、近未 来の治療戦略としては、complete cure, relative cure, palliation と3 つの治療グループに分 けて適応を決める必要があるように思える。
文 献
1. Christopher N, etal: Preoperative and intraoperative
diffusion tensor imaging-based fiber tracking in glioma
surgery. Neurosurgery 56(1): 130-138, 2005
2. Idbaih A, etal:Molecular genetic markers as
predictors of response to chemotherapy in gliomas.
Curr Opin Oncol 19(6): 606-11, 2007
3. Idoate MA, etal: Update on the molecular biology of
gliomas: towards a pathomolecular classification of
gliomas. Rev Neurol 44 (4): 217-24, 2007
4. Ishii D, etal.Efficacy of temozolomide is correlated
with 1p loss and methylation of the deoxyribonucleic
acid repair gene MGMT in malignant gliomas. Neurol
Med Chir(Tokyo) 47:341?350, 2007
5. Jeremic B, etal:Hyperfractionated radiation therapy
for incompletely resected supratentorial low-grade
glioma:a 10-year update of a phase ll study.Int J
Radiat Oncol Biol Phys 57(2): 465-71, 2003
6. Kouwenhoven CMM, etal: 1p/19q loss within
oligodendroglioma is predictive for response to first
line temozolomide but not to salvage treatment. Eur J
Cancer 42(15): 2499-2503, 2006
7. Lindner D, etal:Application of intraoperative 3D
ultrasound during navigated tumor resection.Minim
Invasive Neurosurg 49(4): 197-202, 2006
8. 永根基雄: 悪性神経膠腫の化学療法. No Shinkei Geka
35(5):433-450, 2007
9. Oh DS, etal: A low-field intraoperative MRI system
for glioma surgery : is it worthwhile? Neurosurg Clin
N Am 16(1): 135-41, 2005
10. Riva M, etal:Temozolomide and thalidomide in the
treatment of glioblastoma multiforme. Anticaner Res
27(2): 1067-71, 2007
11. Stephen Y, etal: Molecular diagnostic testing in
malignant gliomas: A practical update on predictive
markers. J Neuropath Exp Neurol 67(1): 1-15, 2008
12. Stupp R, etal:Changing paradigms-an update on the
multidisciplinary management of malignant glioma.The
Oncologist11(2): 165-180, 2006
13. 吉井與志彦: Glioma と放射線治療, pp 1-164, にゅー
ろん社,1992
14. Yoshii Y, etal:Expression of enzymes and oncogene
induced after radiotherapy and/or chemotherapy in
patients with brain tumors. Hum Cell 14: 95-103,2000
15. 吉井與志彦他:Glioma 手術のコツ. 脳腫瘍の外科(長
尾省吾編)、メデイカ出版、pp138-149, 2002
16. Yoshii Y,etal: Cognitive function of patients with
brain tumor in pre- and postoperative stage. Surg
Neurol69; 51-61,2008
Q U E S T I O N !
問題:グリオーマ治療は一筋縄ではいかない難 治性腫瘍であるが、根治が期待できる腫 瘍はどんな場合か?誤りをひとつ選べ。
- 劣位半球に存在する
- 腫瘍の境界は鮮明である
- 非高次機能部に存在する
- 全摘出術が可能である
- 201Tl-SPECT で201Tl の取り込みのある腫 瘍である
CORRECT ANSWER! 9月号(vol.44)の正解
不育症の診断と治療成績
問題:不育症の診断・治療に関する以下の記述 の中で、誤っているものはどれか。
- 抗リン脂質抗体が原因と診断された例の 治療として、抗凝固療法が行われる。
- 自然流産における胎児の約1/4 に染色体 異常を認める。
- HLA-G、HLA-E は胎盤に特異的に発現 するHLA 抗原である。
- 染色体相互転座保因者では、夫婦の正常出 生児に同様の転座が認められる場合がある。
正解 2
10 月号に掲載しました生涯教育コーナーの設問 の部分(62 ページ)に誤りがありましたので、下 記のとおり訂正し、お詫び申し上げます。
(正)3)肺腫瘍ラジオ波焼灼術は、高温により腫 瘍の壊死を起こさせる。
4)肺腫瘍ラジオ波焼灼術は、通常全身麻酔下で行われる。
(誤)3)肺腫瘍ラジオ波焼却術は、高温により腫瘍の壊死を起こさせる。
4)肺腫瘍ラジオ波焼却術は、通常全身麻酔下で行われる。
著 者 紹 介

琉球大学医学部脳神経外科
教授 吉井 與志彦生年月日:
昭和19年 1月1日出身地:
東京都出身大学:
千葉大学医学部
昭和44 年卒略歴
昭和44年3月 千葉大学医学部卒業
昭和50年4月 国立習志野病院脳神経外科医長
昭和51年5月 筑波大学講師(臨床医学系)
昭和53〜55年 米国カリフォルニア大学(UCSF)留学
平成元年6月 筑波大学助教授(臨床医学系)
平成9 年5月 琉球大学医学部教授(脳神経外科学講座)
平成10〜 14年 琉球大学医学部附属病院 救急部長 併任
平成11〜 14年 琉球大学医学部附属病院 総合診療センター部長 併任
平成14〜 16年 琉球大学医学部附属病院 手術部長 併任
平成17〜 18年 琉球大学医学部附属病院病院長補佐
平成17年〜 琉球大学医学部離島医療人養成教育 プログラム(RITO プロ)専門部会長、教育企画室長
平成18〜 20年 琉球大学医学部医学科長
専攻・診療領域
脳神経外科、脳・脊髄腫瘍、脳腫瘍病理、神経放射線著書
「Gliomaと放射線治療」(吉井與志彦著)1992
「脳腫瘍・脊髄腫瘍のMRI診断」(能勢忠男、吉井与志彦編)1993
「脳腫瘍の外科―脳腫瘍の外科のコンセプトと治療向上の工夫―」(吉井與志彦編)2004
他資格
日本脳神経外科学会専門医、医学博士、日本脳卒中学会専門医、日本がん治療認定機構暫定教育医学会および社会における活動等
日本脳神経外科学会評議員、沖縄県医師会脳神経外科分 科会会長、日本脳腫瘍病理学会世話人、「Brain Tumor Pathology」査読委員、重粒子線がん治療中枢神経腫瘍 臨床研究班班員、脳神経外科救急学会顧問、日本老年脳 神経外科学会世話人、日本脳神経外科救急学会理事、 「Neurologia medico-chirurugica」査読委員、日本脳腫 瘍の外科学会理事趣味
釣り、テニス、読書、植物